阿尔茨海默病(AD)是公认的药物研发黑洞。全球第二款Aβ单抗Aduhelm的获批曾令人对AD药物充满信心,但不久后便在高昂的治疗费用、遭受质疑的效果、惨淡的销售情况等打击下黯然退市。好在,药企并未放弃这个市场。
今年7月,卫材/渤健联合开发的阿尔茨海默症新药Leqembi由加速批准转为完全批准,成为20年来首款获FDA完全批准的新疗法。紧接着,礼来的靶向淀粉样蛋白斑块疗法Donanemab也传来好消息,Ⅲ期临床研究显示接受该药物治疗的患者认知功能下降减缓达60%。不过,这些药物依旧只能延缓疾病进展,难以治愈疾病。
近日,又有多篇期刊发布阿尔茨海默病(AD)相关文章……深陷药物研发“死胡同”的阿尔茨海默病,能否迎来丰收季?
新机制能否催生新疗法?
若论神经退行性疾病药物研发的最大阻碍,必然是难以明确的发病机制,神经退行性“代表”疾病阿尔茨海默病同样如此。目前,阿尔茨海默病众多发病机制学说中,有三种学说已成主流,分别为主Aβ级联学说、Tau蛋白异常磷酸化学说以及胆碱能学说。然而,尽管科学家们对阿尔茨海默病的研究已历时多年,其病因却仍未被完全确定,至今仍有新学说被推出。
8月,一项发表在《AnnalsofNeurology》上的研究显示,在阿尔茨海默病和血管性痴呆的情况下,被称为铁死亡的细胞死亡形式破坏了小胶质细胞。小胶质细胞是一种参与大脑免疫反应的细胞,在AD发病机制中占据至关重要的地位。该研究显示,小胶质细胞本身会因清除富含铁的髓鞘质而被破坏,研究者认为,退行性小胶质细胞的级联效应似乎是阿尔茨海默病和血管性痴呆患者认知能力下降的一种机制。
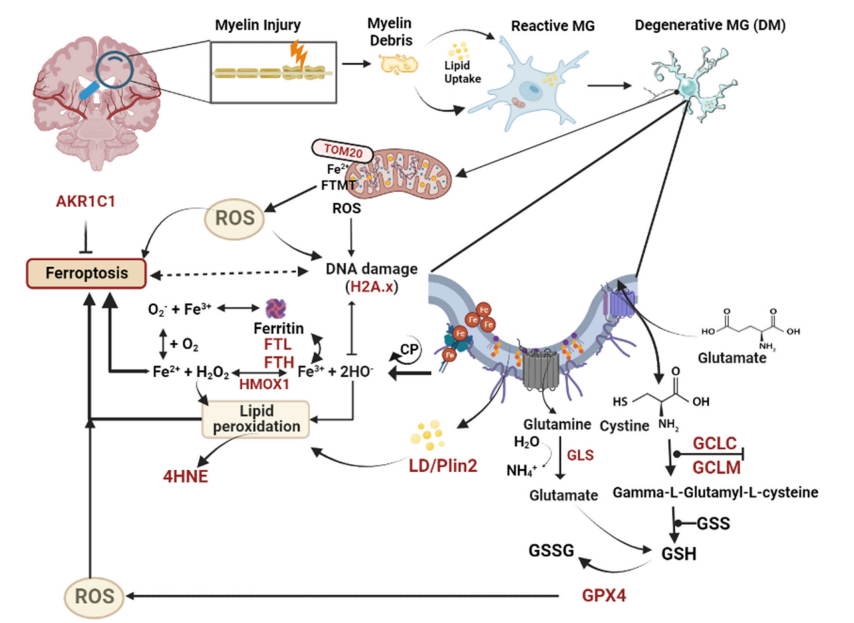
图片来源:参考资料2
这不免让人好奇,新发现是否能用来开发新药物?
为此,药智数据采访了韩国嘉泉大学药学院费翔博士。
费翔博士分享了近日所读的一本畅销书《天使和刺客》(TheAngelandtheAssassin),并借此表达了自己的的看法:“这本书生动介绍了我们大脑内小胶质细胞功能的两面性:“天使”的一面维护大脑环境;“刺客”的一面破坏神经元。
最近研究发现小胶质细胞被证实在干细胞阶段跟身体免疫细胞是同源的,作者认为精神疾病本质是小胶质细胞出现功能紊乱,攻击和吞噬神经突触,或消极怠工不清除有害物质,导致阿尔兹海默症。
回到这篇小胶质细胞的铁死亡的论文,作者发现老人大脑的小胶质细胞吞噬退化神经元并导致早期突触丧失,从而在包括AD在内的脑部退行性疾病的进展中起着至关重要的作用。这篇文章也把铁死亡作为癌症新药研发的热点扩展到了脑部退行性疾病领域。这也为新药研发打开了新的思路。”
“老药”频频新用,
巨型黑洞将现曙光?
药物研发的道路向来不容易。采用明确机制开发新药的过程尚且充满曲折,更何况全新机制。因此,除探索新药物外,老药新用也是疾病研究中永不淘汰的课题。
9月初,一项细胞衰老与阿尔茨海默病相关的I期临床试验结果发表在《NatureMedicine》上,研究者将抗肿瘤药物达沙替尼(Dasatinib)与槲皮素联合以靶向衰老细胞,发现此疗法能够清除大脑中的淀粉样蛋白,降低血液中的炎症。不过,研究者同时强调该试验纳入人数较少,结果仍需斟酌。
除抗肿瘤药物之外,多发性硬化症(MS)药物或许也能治疗阿尔茨海默病。《eBioMedicine》上刊登了一篇研究文章,该研究利用MS药物Ponesimod治疗患有阿尔茨海默病的小鼠,结果显示小鼠的注意力和工作记忆有所改善。此外,研究者还获取到人脑样本进行研究,显示Ponesimod可用于治疗阿尔茨海默病。
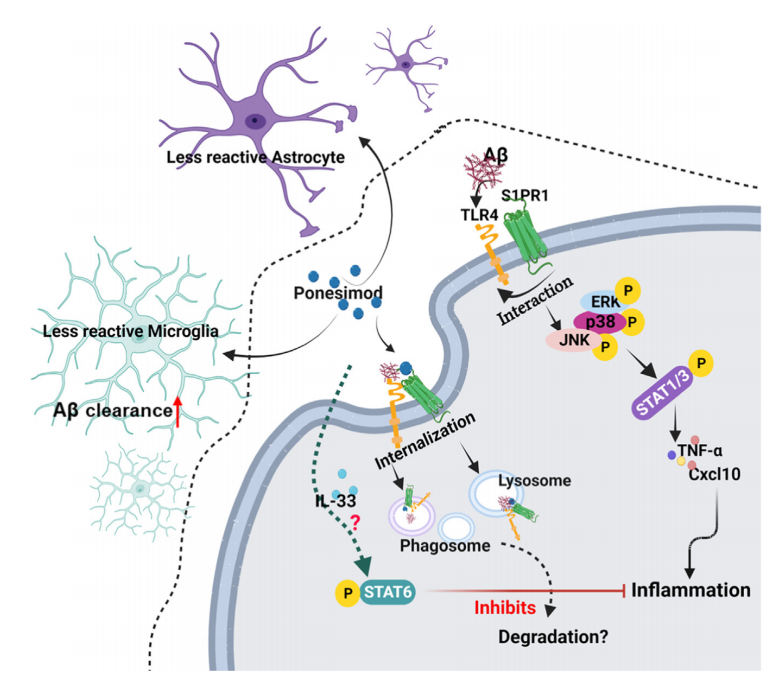
图片来源:参考资料3
此外,今年最火热的GLP-1药物,继降糖、减肥奇效爆火后,又被发现在心血管疾病、肾病中或许能够发挥作用,甚至还能治疗阿尔茨海默病,例如利拉鲁肽和司美格鲁肽。在针对阿尔茨海默病的II期ELAD研究中,利拉鲁肽展现出治疗该疾病进程中出现的大脑萎缩的潜力;司美格鲁肽治疗阿尔茨海默病的临床试验也已进入Ⅲ期,尽管初步试验结果还需等待,但已引得业内高度关注。
对此,费博士分享了他研究生时期的一个故事:“当时老师问了我们一个问题,假如目前有两款药能解除病痛,是选老药还是新药?记得大多硕士生说选择疗效更好的新药,而博士生更多选择了老药。因为相对来说老药的毒副作用更清楚而新药即使疗效更好也可能有尚未发现的副作用。
历史上的反应停(沙利度胺)就是一个教训。由于服用该药物而诞生多达1.2万名这种形状如海豹一样的可怜的婴儿。不过随着进一步研究,逐渐明晰沙利度胺的手性,抛弃了引发生殖毒性的左旋体,右旋体又被重新用于治疗麻风病、多发性骨髓瘤、类风湿性关节炎,成为一个药品从“魔鬼药”到“天使药”的蜕变。”
此外,他还说道:“回到上文提到的几款老药新用的论文,我最感兴趣的是肯塔基大学两位华人女科学家关于S1P受体抑制剂Ponesimod可以减少淀粉样斑块的大小和数量的研究。从分子层面的机理到小鼠模型中观察到了该药物改善空间记忆的证据很值得继续关注。”